mayo de 2010
número 3LA TEORÍA ATÓMICA Y EL MÉTODO CIENTÍFICO
(PARTE I)
Si analizamos cómo ha cambiado el concepto que los científicos han denominado “átomo” podemos asistir a uno de los capítulos más apasionantes en la historia de la ciencia. Siguiendo el hilo cronológico de los modelos teóricos, cada vez más precisos, derivados de los fenómenos observados y de los avances tecnológicos, es posible apreciar el modo en que evoluciona el conocimiento científico y comprender la esencia de su método.
Haremos un breve recorrido a lo largo de los veinticinco siglos que tiene de vida el concepto de átomo citando los momentos cruciales en los que se produjeron los cambios más drásticos, así como los principales responsables de éstos y los hechos experimentales que los indujeron.
José Antonio Montiel Tosso
Profesor de Física y Química
LA CIENCIA Y SU MÉTODO
La Ciencia es un conjunto ordenado y estructurado de conocimientos que la humanidad ha ido elaborando continuamente a lo largo de la historia gracias a las aportaciones de los científicos y pensadores. No es un “ente” estático ni acabado, por el contrario, se halla en constante revisión y evolución, merced a los descubrimientos y novedades que se conocen cada día.
Si algo distingue a la física y la química, como a las demás ciencias experimentales, es la aplicación del método científico con todas sus consecuencias. Podemos afirmar que el progreso en las disciplinas científicas se construye gracias al procedimiento que garantiza la validez de sus conceptos y leyes y que denominamos obviamente como método científico, el cual se basa en la observación de los fenómenos naturales, su posterior estudio en el laboratorio y en el establecimiento de sus posibles explicaciones o hipótesis. A partir de ahí, cuando una determinada hipótesis que se propone como explicación de un hecho es confirmada mediante los experimentos se puede transformar en una ley científica que establezca una relación entre dos o más variables, la cual puede ser enunciada o expresada matemáticamente. Al estudiar un conjunto de leyes relacionadas con un mismo tema, en ocasiones es posible hallar algunas regularidades que den lugar a unos principios generales con los cuales se constituya una teoría.
En un nivel superior, las leyes y las teorías suministran una base para elaborar los modelos. Éstos son una abstracción mental, una interpretación de la naturaleza, dotados generalmente de una estructura lógico-matemática. Se utilizan para poder explicar algunos fenómenos relacionados y para reconstruir por aproximación los rasgos del objeto considerado en la investigación. El modelo será tanto mejor cuanto más se aproxime al comportamiento real del objeto. No es imprescindible que esas interpretaciones sean ciertas, sino que sean útiles y eficaces para el fin que se persigue. Por ejemplo, no importa demasiado saber si los electrones giran en órbitas alrededor del núcleo, sino que lo realmente importante es que se comportan como si lo hicieran. Por eso el modelo atómico, igual que otros, ha sufrido tantos cambios a lo largo de la historia de la ciencia, debido, por un lado, al avance del conocimiento científico y, por otro, al desarrollo de la tecnología que proporciona a la ciencia unos medios cada vez mejores para estudiar la naturaleza.
Es evidente que si se presenta un nuevo fenómeno que no encaja en los límites de una teoría o de un modelo, es necesario revisarlos. Por ejemplo, el modelo de Rutherford tuvo muy poco tiempo de vigencia, pues prácticamente fue concebido con ciertos reparos, pues no era capaz de asumir la estabilidad física del átomo ni la formación de los espectros, propios para cada elemento y reproducibles en cualquier tipo de muestra, lo que les confería un carácter exclusivo y les hacía muy útiles en análisis químico cualitativo (o de identificación). Apenas dos años después, un nuevo modelo, establecido por el danés Böhr, ocupaba su lugar en la interpretación de la estructura atómica.
En definitiva, hemos de pensar en los modelos científicos como concepciones dinámicas, que se modifican y evolucionan constantemente y que son el resultado de las interacciones entre las observaciones y las hipótesis, centro de la actividad científica.
Concretamente, si observamos la evolución del modelo atómico a lo largo de la historia de la ciencia, tendremos un claro ejemplo del modo en que actúa el método científico y la forma en que los nuevos descubrimientos, unidos a los avances tecnológicos, obligan a modificar las ideas imperantes en cada etapa. Además, en el caso que nos ocupa también puede verse la importancia crucial que posee la cooperación entre los científicos y el intercambio de conocimientos conforme avanza la ciencia, pues considerando la gran envergadura teórica de la mecánica cuántica, actual modelo que interpreta la estructura atómica, habría sido materialmente imposible su desarrollo por una sola persona.
LA FILOSOFÍA GRIEGA Y LOS ELEMENTOS
Desde su más remota antigüedad los filósofos griegos se habían preguntado acerca del modo en que estaban constituidas las cosas. Concibieron la idea de elemento primordial que animaba todo lo que hay en la naturaleza. Así, Tales de Mileto, en el siglo VI a.C. pensó que el agua era el componente básico de todas las cosas, y de él partió la idea de que este elemento originaba, mediante transformaciones, el resto de sustancias. Dicho pensamiento tuvo eco en sus contemporáneos aunque no creyeron en el agua como elemento primordial, proponiéndose otros, como el aire para Anaxímenes, también de Mileto, o el fuego para Heráclito de Éfeso (siglo V a.C.)
 Thales de Mileto
Thales de Mileto
No obstante, el salto cualitativo en la noción de elemento lo dio Empédocles de Sicilia, de la escuela pitagórica, en el siglo V a. C., sugiriendo la existencia de varios elementos, los ya conocidos agua, aire y fuego, y un cuarto añadido por él: tierra. De este modo, cualquier sustancia natural se hallaba formada por la combinación de esos cuatro elementos en las proporciones adecuadas. En el siglo IV a. C., Aristóteles de Estagira, el más famoso pensador de la Grecia clásica, asumió esta idea e incluyó un quinto elemento (quintaesencia): el éter, que llenaría los cielos. Con el éter, los antiguos filósofos salvaban el escollo del vacío interestelar, algo inimaginable para su tiempo. Concedían al éter unas propiedades muy especiales, creyéndole un fluido de muy escasa densidad, de una naturaleza tan sutil que se escapaba a la observación, y en el que se moverían, describiendo órbitas circulares todas las estrellas y planetas alrededor de la Tierra, que era considerada entonces como el centro del Universo.
 Aristóteles de Estagira
Aristóteles de Estagira
NACE LA IDEA DE ÁTOMO
Ya en el siglo V a. C., el filósofo jonio Leucipo razonó que todos los cuerpos se pueden dividir por sucesivas particiones hasta llegar a un punto en el cual los tamaños de las partículas sean tan pequeños que impida otra nueva división. Su discípulo Demócrito de Abdera acuñó el término átomo para designar a los menores constituyentes de la materia que no admiten más división. Nacía definitivamente la filosofía atomista, que iba a ser rotundamente denostada por Aristóteles.
Considerando la influencia de Aristóteles en el pensamiento no sólo de su época, sino de muchos siglos posteriores, no es de extrañar que la acertada idea de la existencia de los átomos fuera olvidada por la comunidad científica durante más de dos milenios.
 Demócrito de Abdera
Demócrito de Abdera
VUELVEN LOS ÁTOMOS
Desde que en el siglo XVII, y sobre todo en el XVIII, la Química había adquirido carta de naturaleza como una importante rama del conocimiento humano, se habían descubierto un conjunto de leyes sobre los pesos que intervenían en las combinaciones de sustancias para obtener los compuestos, debidas a los franceses Lavoisier y Proust, y al británico Dalton, las cuales se completaron con las leyes volumétricas de los gases, enunciadas por el francés Gay-Lussac y el italiano Amadeo Avogadro.
Con el fin de explicar dichas leyes, el propio John Dalton volvió a la antigua idea del átomo como constituyente de la materia en su teoría atómica presentada en los inicios del siglo XIX. Afirmó que los átomos de un elemento eran iguales entre sí y que los compuestos se originaban por la unión de átomos de los elementos correspondientes en unas cantidades definidas. Poco después, Avogadro denominó moléculas a los menores constituyentes de los compuestos, formadas por la unión adecuada de sus átomos. En este momento el átomo se identifica con una partícula indivisible.
 John Dalton
John Dalton
El modelo de Dalton tuvo una larga vida, pues hasta finales de siglo, en 1897, no sucedió el hecho que obligó a su revisión: el descubrimiento de los rayos catódicos. El inglés J. J. Thomson consiguió “romper” por primera vez los átomos de un gas al someterlos a elevados potenciales en tubos de descarga, acabando por fin con la antigua y muy arraigada idea de la indivisibilidad del átomo. Así, a finales del siglo XIX, Thomson había estado estudiando los rayos catódicos, continuando las investigaciones de Crookes y Goldstein iniciadas dos décadas atrás. Al introducir gases a muy baja presión en un tubo de vidrio similar al de la figura y someterlos a potenciales eléctricos de 20000 a 100000 voltios se producía la descarga, pero no se observaba luminosidad alguna en el interior del tubo. Sin embargo, en la zona situada frente al cátodo (polo negativo) aparecía una especie de fluorescencia verdosa, atribuida a ciertas radiaciones procedentes del cátodo: los rayos catódicos.
 Rayos catódicos
Rayos catódicos
Thomson estudió las propiedades y efectos de estos rayos y llegó a la conclusión de que estaban constituidos por partículas, con carga eléctrica negativa, dotadas de gran velocidad, casi dos mil veces más pequeñas que el átomo de hidrógeno. Además, las partículas eran idénticas aunque cambiase el gas del tubo. A propuesta de Stoney les dio el nombre de electrones.
 J. J. Thomson
J. J. Thomson
Gracias al experimento del norteamericano Millikan, en 1911, se conocieron los valores de la carga y la masa de estas partículas, confirmándose que son integrantes de todos los átomos y mostrando, por consiguiente, su divisibilidad, como antes señalábamos. Los electrones tienen una masa en reposo de 9,109•10(exp –31) kg y una carga eléctrica negativa de 1,602•10(exp -19) culombios, que es la unidad básica de electricidad.
Sin embargo, el modelo de Thomson aún imaginaba un átomo más o menos esférico, con los electrones incrustados en una masa positiva, resultando un conjunto eléctricamente neutro, una interpretación bastante alejada aún del concepto actual, pero al que debemos concederle la importancia que merece por el hecho de haber roto con el “mito” de la indivisibilidad, pues no olvidemos que el propio término de “átomo” etimológicamente hace referencia exacta a dicha supuesta propiedad.
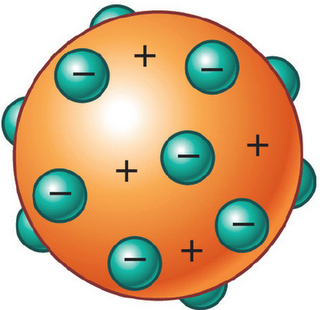 Modelo atómico de Thomson
Modelo atómico de Thomson
LAS ÓRBITAS ELECTRÓNICAS
Paralelamente al estudio de los rayos catódicos se realizaron ensayos similares empleando cátodos perforados, llevados a cabo por el alemán Goldstein, que condujeron al descubrimiento del protón, otra partícula subatómica, de carga positiva e igual a la del electrón.
En un tubo de vacío, muy semejante al del experimento de Thomson, pero con el cátodo perforado, Goldstein efectuó la descarga correspondiente y observó otra luminiscencia situada detrás del cátodo. Pensó que eran unas radiaciones susceptibles de atravesar los canales o agujeros del cátodo y que se movían en sentido contrario a los rayos catódicos. Se denominaron rayos canales. La carga eléctrica era positiva y su masa dependía del gas empleado, siendo los más pequeños los producidos al utilizar hidrógeno, con una masa mucho mayor que la del electrón, su carga igual y de signo contrario, y a los que se denominó protones. Era evidente que los protones formaban parte del átomo, generados al destruirse por causa de la descarga eléctrica dichos átomos de gas.
La masa de un protón es de 1,6726•10(exp -27) kg, aproximadamente 1836 veces la del electrón. Por tanto, la masa de un átomo está concentrada casi exclusivamente en su núcleo. Su carga positiva es igual en magnitud a la carga negativa del electrón y está presente en todos los núcleos atómicos.
Teniendo en cuenta que el átomo estaba constituido fundamentalmente por partículas positivas y negativas, surgió inmediatamente el problema de cómo se hallaban distribuidas. El primer modelo precursor de la concepción actual fue dado por Rutherford en 1911, una época en la que ya se habían descubierto las propiedades radiactivas de ciertos elementos y la naturaleza de esa radiación. De este modo, para enunciar su modelo, Rutherford se basó en una observación previa realizada por él mismo, consistente en bombardear láminas finísimas, de unos 400 Å de espesor, de diversos metales (oro, plata…) con partículas α (He2+). La mayoría atravesaban las láminas sin desviarse, unas pocas se desviaban a diversos ángulos y solamente una pequeña parte, aproximadamente una de cada 20000, se reflejaban en la lámina. De ahí se deduce que estas partículas apenas encuentran obstáculos en su camino y que, por tanto, la mayor parte del volumen de un átomo está vacío. Esta es una nueva idea de gran utilidad para el progreso de la estructura atómica.
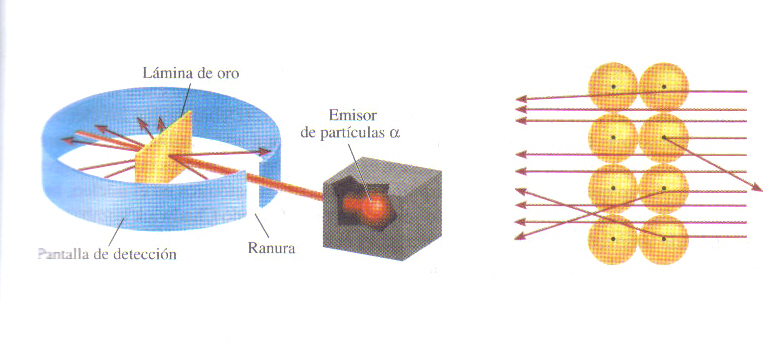 Experimento de Rutherford
Experimento de Rutherford
Basándose en las medidas cuantitativas de las desviaciones, Rutherford postuló el siguiente modelo: El átomo está constituido por un núcleo en el que se encuentra localizada la casi totalidad de la masa atómica y toda la carga positiva. En torno a este núcleo, y a grandes distancias de él, giran los electrones en la corteza gracias a la acción de las fuerzas electrostáticas. Según los resultados de Rutherford, el tamaño de la corteza es unas cien mil veces mayor que el del núcleo. Además, con el fin de que el átomo sea eléctricamente neutro, el número de cargas positivas del núcleo ha de ser igual al de electrones.
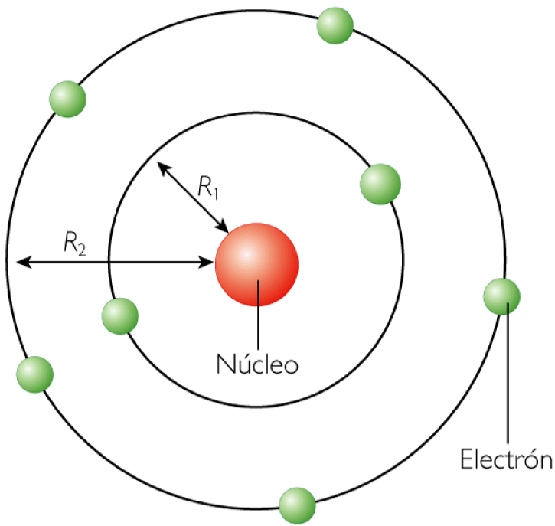 Modelo de Rutherford
Modelo de Rutherford
Cuantitativamente, el radio de las órbitas electrónicas se puede calcular de un modo aproximado. Consideremos un átomo con Z cargas positivas y un solo electrón, como H o He+. Puesto que la fuerza centrípeta que gobierna el movimiento viene representada por la atracción electrostática entre el electrón y el núcleo, podemos establecer la siguiente igualdad:Ze(exp 2)/R(exp 2) = mv(exp 2)/R, donde R es el radio de la órbita y m, e y v son, respectivamente, la masa, la carga y la velocidad del electrón.
Despejando R, obtenemos la expresión: R = Ze(exp 2)/mv(exp 2), en la que R es el radio de giro del electrón y, por consiguiente, el radio atómico. De este resultado se deduce que el radio es inversamente proporcional al cuadrado de la velocidad, y viceversa, la velocidad será tanto mayor cuanto más próximo al núcleo se encuentre el electrón.
La energía total E es la suma de la cinética (Ec) y de la potencial (Ep). La energía cinética del electrón es: Ec = ½ mv(exp 2), mientras que la energía potencial es igual, con signo contrario, al trabajo necesario para alejar la carga negativa desde donde está (a una distancia R de la carga positiva) hasta el infinito, o sea, Ep = -Ze(exp 2)/R. Por tanto, tras sumar dichas expresiones y teniendo en cuenta la ecuación del radio nos queda para la energía total: E = -Ze(exp 2)/2R.
La energía es negativa por el convenio de signos, e indica que cuando se forma el átomo por adición del electrón hay desprendimiento de energía.
Este modelo tiene algunos errores graves. De acuerdo con la teoría electromagnética clásica, una carga eléctrica en movimiento circular debe emitir radiación y, por ello, perder energía. Según la expresión anterior, si pierde energía debe disminuir R, por lo que, eventualmente, el electrón caerá sobre el núcleo. Además, en el modelo hay continuidad geométrica y energética, es decir, cualquier valor de R y de E son posibles, lo que está en manifiesta contradicción con los espectros atómicos. Por otra parte, en tiempos de Rutherford no se conocían los neutrones, y no se incluyen en el modelo.
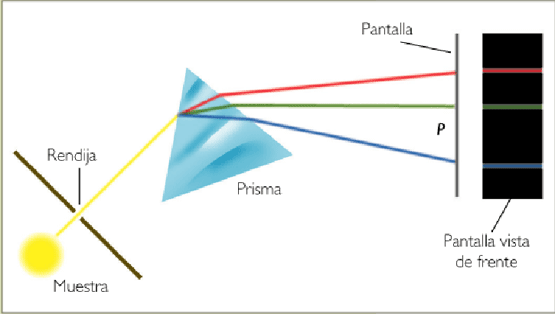 Obtención de un espectro atómico
Obtención de un espectro atómico
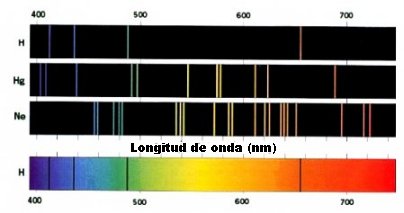 Algunos espectros atómicos
Algunos espectros atómicos
A pesar de todo, quiero resaltar la aportación que hizo y el impulso que dio a la teoría atómica el modelo de Rutherford. Básicamente, en primer lugar propuso la novedosa idea de las órbitas electrónicas y, en segundo lugar, acabó con el “horror al vacío”, una idea que había impregnado la física desde los tiempos de los filósofos griegos, defendida sobre todo por Aristóteles. Rutherford demostró que el interior del átomo es esencialmente un espacio vacío, surcado ocasionalmente por diminutos electrones. Haciendo una ampliación de escala para el átomo de hidrógeno, si su protón tuviese las dimensiones de una esfera de un metro de diámetro, su electrón “compañero” sería una esfera de menos de un centímetro de diámetro y que viajaría en una órbita de unos cien kilómetros. Asombroso…y en medio, entre ambos…nada, “espacio vacío”.
A finales del siglo XIX los físicos tenían el convencimiento de que su ciencia estaba concluyendo con rotundo éxito la interpretación y la descripción exacta del mundo. Creían que los pocos cabos sueltos que aún quedaban por atar no iban a representar ningún problema relevante. Uno de los teóricos más importantes del momento, Max Born, llegó a decir que la física era prácticamente una ciencia cerrada, descartando la idea de nuevos descubrimientos de interés. Nada más lejos de la realidad...
(Continúa en el próximo número)
| ISSN: 1988-9607 | Redacción | www.iesseneca.net |


 Versión imprimir
Versión imprimir