junio de 2015
número 5LA TEORÍA ATÓMICA Y EL MÉTODO CIENTÍFICO (PARTE III)
José Antonio Montiel Tosso
Profesor del Departamento de Física y Química
En números anteriores hemos estudiado la evolución de los modelos atómicos de acuerdo a la aplicación del método científico a la luz de los nuevos descubrimientos y como consecuencia del desarrollo de los métodos experimentales.
Así, en la parte I se describió el “nacimiento” del concepto de átomo en el seno de la Grecia clásica y posteriormente se presentaron los primeros modelos atómicos de la química moderna, debidos a Dalton, Thomson y Rutherford (Ver artículo).
Igualmente, en la parte II dedicamos nuestra atención a la “revolucionaria” teoría cuántica de Planck y a su utilización, gracias a Niels Böhr, en la interpretación de la estructura atómica, destacando también su relevancia en la explicación del efecto fotoeléctrico, elaborada por Albert Einstein (Ver artículo).
Al desarrollarse la mecánica cuántica en la década de 1920, a la teoría de Planck ya conocida se unió la hipótesis de De Broglie de la dualidad onda-corpúsculo (1924) y el principio de incertidumbre de Heisenberg (1927), que permitieron aplicar el cálculo matemático a la descripción del átomo y a la interpretación teórica de los descubrimientos experimentales como el de Davisson y Germer, por un lado, y el de G.P. Thomson, por otro, llegando a dos formulaciones paralelas y equivalentes: la mecánica de matrices del mismo Heisenberg y la mecánica ondulatoria de Schrödinger (1927).
LA DUALIDAD CUÁNTICA
El modelo de Böhr sólo permitía explicar suficientemente bien el espectro del Hidrógeno, sin embargo fallaba con los demás átomos. De cualquier modo constituyó el inicio del enorme avance de la física en la década de los años 20, que culminó con la mecánica cuántica, el modelo atómico que hoy sigue vigente. El edificio de la nueva mecánica se basa en tres pilares: la teoría de Planck, ya comentada en la parte II, y en otros dos enunciados fundamentales, la dualidad onda-corpúsculo y el principio de incertidumbre.
La hipótesis de la dualidad onda-partícula se debe a Louis De Broglie, quien en 1924 la estableció así: cualquier partícula de masa m y velocidad v lleva asociada en su movimiento una onda, cuya longitud de onda (λ) se calcula mediante la expresión:
λ = h/(m•v)
Esta idea supone que los electrones se pueden comportar en determinados experimentos como si fuesen ondas igual que la luz se manifiesta, a veces, como si tuviese una naturaleza corpuscular. Pocos años después, Davisson y Germer demostraron la naturaleza ondulatoria de los electrones al realizar experimentos de reflexión similares a los rayos X. También Thomson realizó experiencias de difracción con electrones, un fenómeno típicamente ondulatorio.
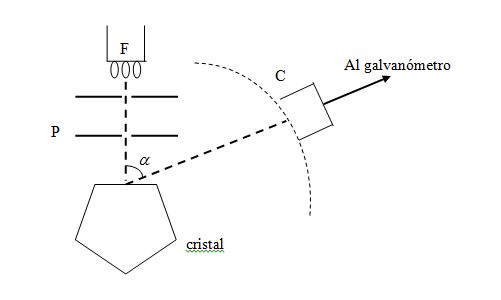
EXPERIENCIA DE DAVISSON Y GERMER
Realizando cálculos sencillos con la ecuación anterior obtenemos para un electrón que se mueva a gran velocidad una longitud de onda asociada del mismo orden de magnitud que las distancias interatómicas en los cristales y se pensó en utilizar dichos cristales como redes de difracción para electrones, igual que antes se habían empleado para difractar con éxito rayos X.
Este experimento fue llevado a cabo en 1927 por Davisson y Germer. Ellos utilizaron electrones emitidos por un filamento de wolframio (F en la figura), que, tras ser acelerados por una cierta diferencia de potencial, son dispersados por un cristal de níquel, pudiéndose observar una serie de figuras de interferencias. De los datos de dichas figuras y de las distancias interatómicas en el níquel obtenidas por difracción de rayos X, se deduce un valor para la longitud de onda asociada a los electrones de 1,65 Å, que concuerda perfectamente con el calculado al aplicar la hipótesis de De Broglie.
Este es un claro ejemplo de la capacidad predictiva del método científico. Las hipótesis sirven para proponer la realidad de un fenómeno aún no conocido. Se diseña el experimento y se constata la observación del hecho tal y como se había predicho. Así, la teoría consigue su validación.
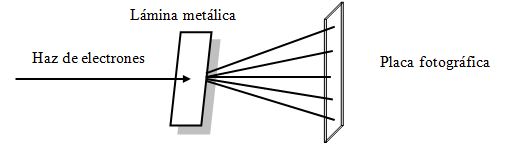
EXPERIENCIA DE G. P. THOMSON
Desarrollando un procedimiento similar al utilizado por Laue para obtener los espectros de rayos X, G. P. Thomson, en 1928, consiguió preparar espectros de difracción de electrones. Utilizó un tubo de gas con potenciales de unos 50.000 V para producir rayos catódicos que luego enviaba contra una lámina metálica. El haz de electrones, tras chocar contra la lámina metálica y ser dispersados incidía sobre la placa fotográfica. El espectro obtenido consistía en un conjunto de anillos perfectamente delimitados, concéntricos y con una mancha central, totalmente análogo a los que se obtienen por difracción de la luz.
Estas experiencias de Thomson, Davisson y Germer, y otras muchas, confirman la hipótesis de De Broglie, según la cual existe un movimiento ondulatorio asociado a las partículas. Como ya hemos dicho, son ejemplos en los que se manifiestan la capacidad de predicción de las teorías científicas vigentes, ya que, el método científico no sólo se centra en la interpretación teórica de los hechos experimentales sino que busca la confirmación práctica de las consecuencias que pueden extraerse de las teorías.
En los objetos macroscópicos las velocidades son mucho menores y las longitudes de las ondas asociadas son tan pequeñas que no pueden detectarse.
EL PRINCIPIO DE INCERTIDUMBRE
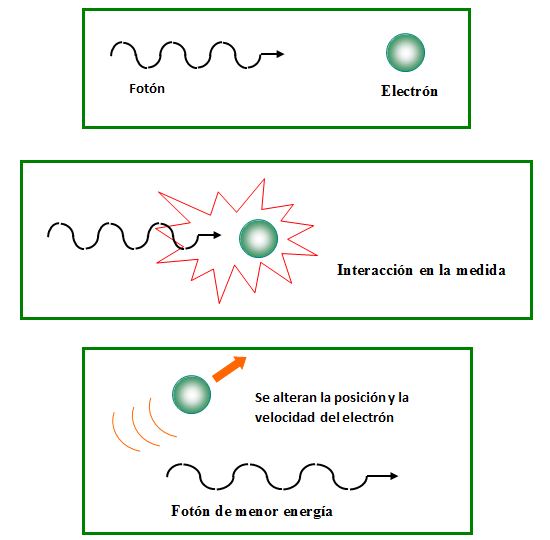
Esta doble naturaleza del electrón, como onda y como partícula, llevó a Heisenberg a enunciar en 1927 su Principio de Incertidumbre: Es imposible conocer simultáneamente y con exactitud el momento lineal (o cantidad de movimiento) y la posición de una partícula. Estableció incluso una fórmula que relaciona la indeterminación en la medida de la cantidad de movimiento (Δp) y de la posición (Δx):
∆p•∆x ≥ h/4 π
Werner Heisenberg
Así, por ejemplo, cuando queremos ver el lugar donde se halla un electrón es necesario iluminarlo directamente con una determinada radiación, cuyos fotones poseen una energía similar a la del electrón, por lo que al incidir sobre él influyen en su movimiento, provocando un aumento en el error de la velocidad.
LA MECÁNICA CUÁNTICA
Las consecuencias que tiene este Principio en la escala atómica son muy claras. En primer lugar, los conceptos de posición y velocidad de un electrón tienen que ser reemplazados por los de probabilidad de que el electrón tenga una velocidad y una posición dadas. Es decir, la introducción de la idea de probabilidad, fundamental en la Mecánica Cuántica, es una deducción directa del principio de incertidumbre. En el desarrollo casi inmediato de la nueva mecánica se describe el estado del electrón mediante unas funciones de onda cuyos cuadrados se corresponden con la probabilidad de hallar al electrón en cada punto del espacio, de manera que es factible realizar unas representaciones gráficas que recojan las diferentes zonas en torno al núcleo donde se mueve el electrón la mayor parte del tiempo. En eso consisten los orbitales.
Eso quiere decir que está superado el modelo de Böhr desde el momento en que no podemos circunscribir a órbitas el movimiento del electrón. Ahora se le puede “encontrar” en cualquier punto del espacio. La mecánica newtoniana y sus ecuaciones que describen la trayectoria de un móvil, ya no sirven. Es necesario formular un nuevo tratamiento matemático que tenga en cuenta los principios básicos de la mecánica cuántica y que los incluya en su desarrollo. En ese momento tuvo lugar el profundo cambio conceptual que sacudió a la comunidad científica en el primer cuarto del siglo XX. En el mismo año 1927, Werner Heisenberg y Erwin Schrödinger llevaron a cabo un estudio paralelo del movimiento del electrón en torno al núcleo bajo las nuevas premisas con formulaciones muy distintas en la forma pero idénticas en el fondo. Ambas describían perfectamente la estructura atómica y explicaban por completo los espectros, no sólo el caso del hidrógeno, sino de cualquier átomo polielectrónico. Son dos tratamientos matemáticos: la mecánica de matrices de Heisenberg y la mecánica ondulatoria de Schrödinger. Tienen una forma muy distinta aunque un resultado idéntico.
Erwin Schrödinger
Heisenberg representa la situación del electrón mediante un conjunto de números que describen los estados inicial y final de una transición. Otro conjunto de números similar representa las velocidades en el estado inicial y en el final. En el desarrollo matemático se asimila el comportamiento del electrón en el átomo al de un oscilador armónico y al calcular los valores posibles de la energía se deben aplicar las reglas del producto de matrices. Heisenberg compara al electrón con un oscilador armónico al asumir la validez de un modelo científico y no identificarlo con una realidad. Sabemos que, en su comportamiento dual, al electrón se le imagina una onda asociada del tipo estacionaria, es decir, sin pérdidas globales de energía y donde los vientres (crestas) y nodos (puntos de elongación nula) ocupan posiciones permanentes. Y recordemos que las ondas estacionarias son un caso especial de interferencia entre una onda armónica y su onda reflejada. Por último, un oscilador armónico es el foco que produce una onda armónica, es decir, el movimiento de dicho foco es armónico simple. De ahí la razón de esta comparación.
No obstante, el desarrollo matemático de la mecánica matricial es demasiado abstracto y no atrajo a la comunidad científica a pesar de los excelentes resultados. La mecánica ondulatoria proporciona una visión mucho más intuitiva del átomo, imponiéndose frente al otro tratamiento. El planteamiento de Schrödinger ofrece una interpretación física más clara. Para este físico austriaco, el movimiento del electrón, contemplado desde el punto de vista ondulatorio, viene descrito por su función de onda Ψ, de modo que en la correspondiente ecuación que describe los estados de energía en su movimiento, llamada ecuación de onda, se incorporan las características de partícula, es decir, su masa y su velocidad. Así, las soluciones de dicha ecuación, denominadas orbitales, representan los posibles estados de energía del electrón y las funciones de onda asociadas a los mismos.
Hemos de insistir en que el concepto de orbital es puramente cuántico, derivado de la hipótesis de De Broglie y el Principio de Incertidumbre. Ya no es válido imaginar al electrón describiendo trayectorias elípticas alrededor del núcleo, como mostraba el modelo de Böhr, sino que hemos de entenderlo como una “nube de carga” en torno al núcleo, como si dicho electrón se pudiese “distribuir” por toda la nube. De esta manera, su movimiento no se localiza en una órbita determinada, sino que se circunscribe a una región del espacio, su orbital, de manera que se puede “hallar” en cualquiera de sus puntos en cada instante concreto y lo único que la mecánica cuántica puede hacer es asignarle una probabilidad de encontrar al electrón en cada punto del espacio.
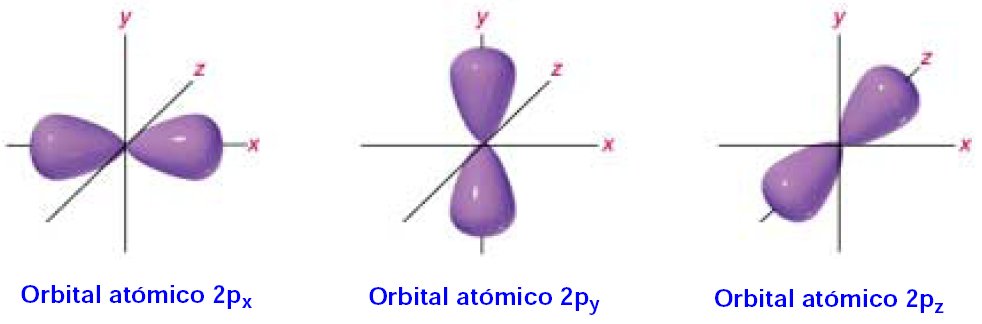
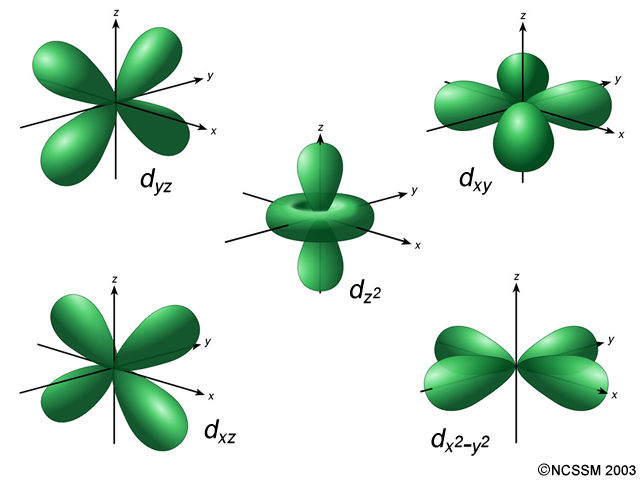
En la resolución de la ecuación de onda surgen, por exigencias matemáticas, los números cuánticos ya descritos desde el modelo de Böhr (completado por Sommerfeld) y con los mismos valores, por lo que se mantienen sus nombres e interpretaciones. De este modo, un orbital queda descrito mediante tres números cuánticos: el “n” (principal) señala su tamaño, el “l” (orbital o secundario) su forma, y el “m” (magnético) su orientación espacial. Además, para describir la energía del electrón ahora es necesario introducir un cuarto número cuántico, el espín, “s”, cuyos valores +½ y - ½, se asocian a los dos posibles sentidos de la rotación del electrón sobre su eje.
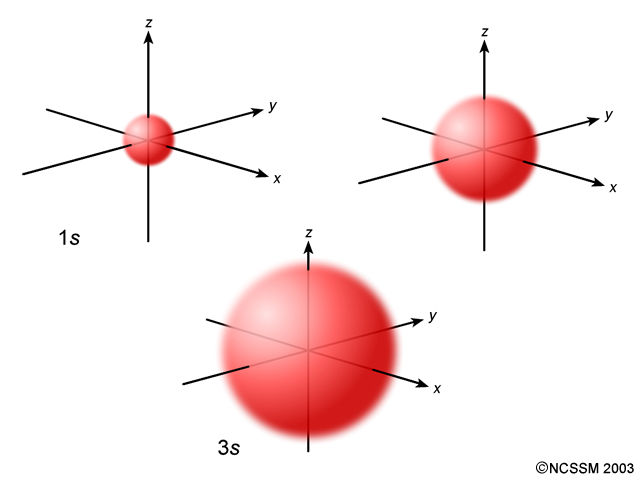
Los valores posibles de l se designan por letras: s para 0, p para 1, d para 2 y f para 3, cuyas representaciones gráficas se muestran en la figura. El orbital tipo s es esférico (con m=0 siempre), el p consta de dos lóbulos opuestos y adopta tres posibles orientaciones (m=—1, m=0 y m=+1) y el d consta de cuatro lóbulos simétricos con cinco orientaciones (m=—2, m=—1, m=0, m=+1 y m=+2).
La importancia de este tratamiento frente al hecho simultáneamente por Heisenberg, basado en cálculos con matrices para representar la posición y el momento lineal del electrón, reside en el significado que tiene el cuadrado de la función de onda, Ψ2, pues representa la probabilidad de encontrar al electrón en cada punto del espacio con un nivel de energía determinado, lo que nos permite conocer el orbital que ocupa y representarlo gráficamente. Es importante remarcar la idea de que, ahora, el electrón no se imagina moviéndose por unas órbitas concretas sino que se halla en una zona determinada en torno al núcleo. De este modo, podemos decir que un orbital es la región del espacio alrededor del núcleo en la que hay una alta probabilidad de encontrar al electrón con una energía determinada.
Evidentemente, el modelo cuántico explica a la perfección todos los hechos observados, no sólo para el átomo de hidrógeno, sino para todos los átomos polielectrónicos, junto con sus enlaces en la formación de las moléculas y proporciona la base del estudio del núcleo, uno de los principales retos de la física teórica actual.
EL NEUTRÓN
La existencia del neutrón fue profetizada en 1920 por el físico británico Ernest Rutherford y por científicos australianos y estadounidenses, pues los resultados experimentales de las mediciones de las masas atómicas eran mayores a los que teóricamente deberían mostrar si dichos átomos estuvieran constituidos únicamente por protones y electrones.No obstante, la verificación experimental resultó difícil debido a que la carga eléctrica del neutrón es nula y la mayoría de los detectores de partículas sólo registran las partículas cargadas.
El neutrón fue identificado en 1932 por el británico James Chadwick, que interpretó correctamente los resultados de los experimentos realizados en aquella época por los físicos franceses Irene y Frédéric Joliot-Curie, entre otros. Ellos habían producido un tipo de radiación anteriormente desconocida mediante la interacción de partículas alfa con núcleos de berilio. Cuando esta radiación se hacía pasar a través de una capa de parafina, las colisiones entre la radiación y los átomos de hidrógeno de la parafina producían protones fácilmente detectables. Chadwick se dio cuenta de que la radiación estaba formada por neutrones.
James Chadwick
La masa de un neutrón es de 1,675•10-27 kg, aproximadamente un 0,125 % mayor que la del protón. Está presente en todos los núcleos, salvo el del hidrógeno ordinario.
Tras este descubrimiento, el conocimiento del átomo tuvo un avance definitivo. Ahora, el reto de la física cuántica es llegar a la interpretación de las interacciones fundamentales y con ello, desentrañar el misterio de la estructura del núcleo atómico. Para este cometido son necesarias enormes cantidades de energía que sólo en unas instalaciones como las del CERN de Ginebra pueden alcanzar. Los diseños experimentales se han vuelto muy sofisticados, con meses de preparación y otros más de interpretación de los millones de colisiones y sucesos verificados en su acelerador LEP, pero la física de partículas no pierde la esperanza de que en un futuro cercano el modelo atómico sea completo e incluya al enigmático núcleo, la naturaleza de las interacciones y la estructura del vacío. En dichas cuestiones se le supone un papel relevante a una todavía hipotética partícula, el bosón de Higgs, del que ya parecen existir fundadas evidencias aún sin confirmar definitivamente.
| ISSN: 1988-9607 | Redacción | www.iesseneca.net |


 Versión imprimir
Versión imprimir